Sıcaklık
Bütün maddelerin atom ya da moleküllerden oluştuğunu daha önceki yıllarda öğrenmiştik. Bu atom ya da moleküller devamlı titreşim (hareket) halindedir. Bir cismin sıcaklığı 0 °K’e kadar düşürüldüğünde (bu sıcaklık değerine hiç bir zaman ulaşılamaz) o maddedeki atom veya moleküllerin hareket edemeyeceği kabul edilir. Maddenin sıcaklığı arttırıldığında ise atom ya da moleküller titreşmeye başlar.
Buna göre sıcaklık, bir sistemde rastgele hareket eden moleküllerin ortalama kinetik enerjilerinin bir göstergesidir. Sıcaklık T harfi ile gösterilir ve bir enerji çeşidi değildir.
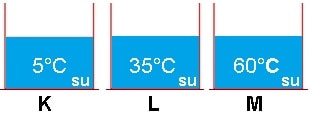
Şekildeki düzenekte bir elini K kabına diğer elini L kabına sokan bir öğrenci K kabındaki suyun soğuk, L kabındaki suyun sıcak olduğunu söyler. Daha sonra öğrenci K kabındaki elini çıkarıp M kabına soktuğunda, L kabındaki suyun soğuk, M kabındaki suyun sıcak olduğunu söyler. Bundan dolayı günlük yaşamda kullandığımız sıcak, soğuk, çok sıcak, çok soğuk gibi ifadeler çok fazla anlam taşımayabilir. Bu ifadelerin kabul görmesi için sıcaklığın duyu organları ile değil, belli bir ölçek yardımıyla ölçülüp, nicel değerleri ifade edilmelidir.
Algı farklılığından kaynaklanan bu tür değerlendirmeleri ortadan kaldırmak ve ölçümlerin nicel sonuçlarını bilimsel bir ölçekle ifade edebilmek için bilim insanları termometreleri geliştirmiştir.
Termometreler
Bir cismin veya bir ortamın sıcaklığı termometre ile ölçülür. Termometreler, maddelerin genleşmesinden faydalanılarak yapılır. Ayrıca termometrede kullanılan maddenin cinsi de önemlidir. Bazı maddeler çok düşük sıcaklıklarda hal değiştirirken bazıları ise yüksek sıcaklıklarda hal değiştirir.
Buna bağlı olarak çok düşük ve çok yüksek sıcaklıkları ölçebilmek için değişik termometre türleri geliştirilmiştir.
Katı (Metal Çiftli) Termometreler
Genleşme katsayıları farklı iki metal şeridin birbirine perçinlenmesi ile oluşturulur. Çok yüksek sıcaklıkları ölçmek için kullanılır.
Gazlı Termometreler
Çok düşük sıcaklık değerlerini ölçmek için kullanılır. Gazların sıcaklık değişimi ile basınçlarının özelliğine göre çalışırlar.
Sıvılı Termometreler
Termometrenin haznesine konulan sıvının genleşme özelliğine göre tasarlanır.
Termometre ile ölçüm yapılabilmesi için, termometrenin içindeki sıvının hal değiştirmemesi gerekir. Sivili termometreler orta sıcaklık değerlerini ölçmek için kullanılır. Günlük yaşamda en yaygın termometredir.
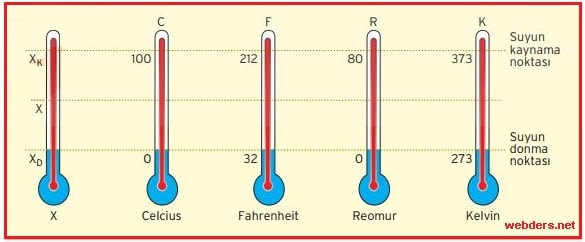
Sıvılı bir termometrenin ölçebileceği en küçük sıcaklık değeri (hassasiyeti), sıvı haznesinin büyüklüğüne, kullanılan sıvının genleşme katsayısına, içinde sıvının yükseldiği kılcal cam borunun ince olmasına ve cam borudaki bölme sayısına bağlıdır. Suyun donma sıcaklığını O °C, kaynama sıcaklığını 100 °C olarak işaretlediğimiz termometre Celcius termometresidir. Aynı şekilde suyun donma ve kaynama sıcaklıkları farklı işaretlenmiş termometreler vardır.
Termometrelerin gösterdiği değerler arasındaki ilişki,
(X – XD)/ (XK – XD) = C/100 = (F – 32)/180 = R/80 = (K – 273)/100
Bağıntısı ile bulunur.
Termometre ölçeklendirilirken suyun donma sıcaklığında ve kaynama sıcaklığında termometrenin kılcal borusundaki sıvı seviyeleri işaretlenir ve daha sonra bölmelendirme yapılır.
Isı bir enerjidir. Maddenin ortak özelliklerinden biri de tanecikli yapıdır. Bu taneciklerin sahip olduğu toplam enerjiye iç enerji denir. Dışarıdan enerji alındığı zaman maddenin iç enerjisi artar. Tanecikler arasındaki bağlar zayıflar. Bu durumda katı maddelerde titreşim hareketi, sıvı moleküllerinde titreşim ve dönme hareketi, gaz moleküllerinde titreşim, öteleme ve dönme hareketi olur.
Isı bir enerji çeşidi olup Q harfi ile gösterilir. Kalorimetre kabı ile ölçülür ve birimi enerji birimi olan kalori ya da joule dur. 1 cal yaklaşık olarak 4,18 joule’e eşittir.
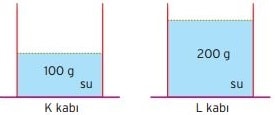
Şekildeki K ve L kaplarına eşit miktar ısı enerjisi verildiğinde K kabındaki suyun sıcaklığının L kabındaki suyun sıcaklığından daha çok arttığı görülür.
Bunun nedeni K kabındaki birim molekül başına düşen ısı enerjisinin daha çok olmasıdır.
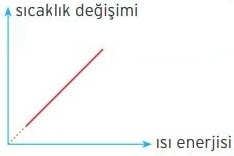
Hal değiştirmeyen bir maddeye verilen ısı enerjisi ile maddenin sıcaklık artışı doğru orantılıdır. Bir maddenin sıcaklık değişiminin maddeye verilen ısı enerjisine bağlı değişim grafiği şekildeki gibidir.
Bir maddenin sıcaklık farkından dolayı ısı enerjisi değişimi;
Q = m.c.ΔT bağıntısı ile hesaplanır.
Burada m kütle (g), c özısı (cal/g. °C), ΔT ise sıcaklık değişimidir.
Isı enerjisinin biriminin calori olduğunu daha önce belirtmiştik. 11 °C deki 1 g suyun sıcaklığını 12 °C ye çıkarmak için suya verilmesi gereken enerji değerine 1 calori denir.
Herhangi bir maddenin 1g’nının sıcaklığını 1°C arttırmak için maddeye verilmesi gereken ya da maddenin vermesi gereken ısı miktarına özısı (ısınma ısısı) denir. Özısı maddeler için ayırt edici bir özelliktir.
Bir maddenin kütlesi ile özgül ısısının çarpımı bize o maddenin ısı sığasını verir. Isı sığası C ile gösterilir ve C = m.c formülü ile ifade edilir. Aşağıdaki tabloda bazı maddelerin özgül ısı değerleri verilmiştir.
| Madde | Özısı |
|---|---|
| Su | 1 |
| Etil alkol | 0,6 |
| Buz | 0,5 |
| Oksijen | 0,22 |
| Demir | 0,115 |
Denizlerin karalara oranla geç ısının geç soğuduğunu biliyorsunuz. Bu durum deniz suyunun özgül ısısının karalardan daha büyük olmasıyla açıklanır. Özgül ısısı büyük olan deniz suyu, karalara oranla daha fazla enerji soğurur.
Suyun özgül ısısının büyük olması, ısıtma ve soğutma sistemlerinde avantaj olarak kullanılmaktadır. Örneğin su, otomobillerde ve motorlarda soğutma amaçlı kullanılırken; sıcak su torbalarında ve kalorifer sistemlerinde (peteklerde) ısıtma amaçlı kullanılmaktadır. Ayrıca klimalarda hem soğutma hem de ısıtma amaçlı kullanılır.
Isıl Denge ve Isı Alış Verişi
Sıcaklıkları farklı iki cisim, ısıca yalıtılmış bir ortamda bir araya getirilirse, sıcaklığı yüksek olan maddeden sıcaklığı düşük olan maddeye doğru ısı akışı olur.
Bu olay cisimlerin sıcaklıkları eşit oluncaya kadar devam eder.
Cisimlerin sıcaklıklarının eşit olduğu sıcaklığa denge sıcaklığı denir ve cisimler denge sıcaklığına ulaştıktan sonra sıcaklıkları değişmez.
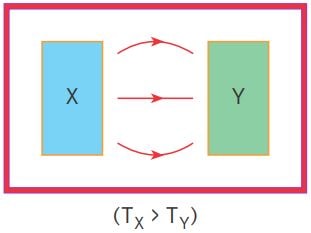
Şekildeki düzenekte sıcaklıkları arasında Tx > Ty ilişkisi olan X, Y cisimleri yalıtılmış ortamda bir araya konulduğunda X in sıcaklığı azalır, Y’nin sıcaklığı artar. Isı bir enerji çeşidi olup, korunumlu olduğundan cisimlerin ısı enerjisi değişimleri eşit olur. Son durumda cisimler denge sıcaklığına ulaşır.
Bu deney farklı cisimler bir araya konulup tekrarlandığında, son durumda bütün cisimlerin sıcaklıkları eşit olur. Bu durum termodinamiğin sıfırıncı yasası olarak adlandırılır. Bu yasaya göre, iki ayrı cisim bir üçüncü cisimle ısıl dengede olması durumunda, cisimler kendi aralarında da ısıl dengede olur.
Isıl dengeye ulaşana kadar verilen ısı ile alınan ısı eşittir. Tabi bu durumda ısı kaybının olmadığı varsayılmalıdır. Isı kaybı yoksa Qalınan = Qverilen olur.
Isı Nasıl İletilir?
Isı enerjisinin sıcaklığı yüksek olan maddeden sıcaklığı düşük olan maddeye doğru aktığını belirtmiştik. Şimdi ise ısı enerjisinin nasıl yayıldığını ya da nasıl iletildiğini öğrenelim.
Isı üç yolla iletilip yayılır. Bunlar şu şekildedir:
- İletim yoluyla
- Taşıma (konveksiyon) yoluyla
- Işıma (radyasyon) yoluyula
Bunları birer birer inceleyim.
Isının İletim Yolu İle Yayılması
Isı iletim yolu ile en iyi katılarda iletilir. Katı haldeki maddeler ısıtıldığında, ısı enerjisi taneciklerin titreşimini artırır. Katı halde iken madde molekülleri birbirine çok yakın olduğu için, titreşimi artan tanecik, çevresindeki taneciklere daha hızla çarparak onların titreşimini artırır. Bu şekilde ısı enerjisi bir tanecikten diğer taneciğe titreşim yolu ile aktarılmış olur. Bir süre sonra tüm taneciklerin titreşimi artacağından ısı enerjisi katı maddenin bir ucundan diğer ucuna iletilmiş olur.
Sıcaklık farkları nedeniyle enerji aktarımına ısı iletimi denir.
Genelde metaller iyi iletkendir. Isıyı iletim yolu ile yayan katı maddelerden bazıları ısıyı çok hızlı iletirken, bazılarının ısı iletimi oldukça yavaştır. Bu nedenle, yemek pişirirken metal kaşık yerine tahta kaşık kullanılır. Metallerin ısı iletkenliği hızlı olduğu için metal kaşık kullandığımızda elimizin kısa sürede yandığını hissederiz. Hâlbuki tahtanın ısı iletim hızı çok yavaş olduğu için uzun süre elimizi yakmadan tahta kaşıkla yemeği karıştırabiliriz. Bir metalin ısı iletim hızı, ısıtılan maddenin özelliklerine bağlıdır. Genelde metaller çok iyi ısı iletkenidir ve mantar, kâğıt ve fiber gibi malzemeler zayıf iletkendirler. Metaller, içinde hareket eden ve enerjiyi bir bölgeden diğerine taşıyabilen serbest elektronlardan çok sayıda içerdiklerinden iyi ısı iletkenidirler.
Isı iletimi sadece, iletim ortamının iki noktası arasında sıcaklık farkı varsa oluşur. Bu şekilde ısı sıcak uçtan soğuk uca doğru akar.
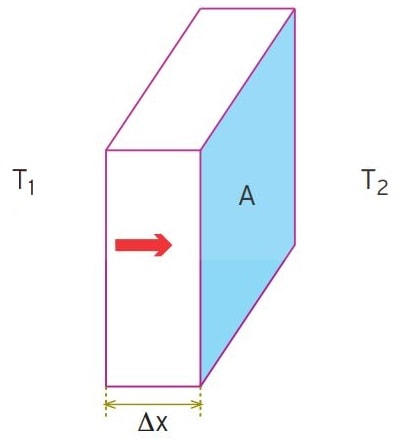
Şekilde yüzey alanı A, kalınlığı Δx olan madde Δt sürede sıcak yüzeyden, soğuk yüzeye Q kadar ısı aktarmış olsun. Isının akış hızı olan Q/Δt kesit alanı ve sıcaklık farkı ile doğru, kalınlık ile ters orantılıdır.
k: ısı iletim katsayısı olmak üzere, bu nicelikler arasındaki ilişki,
ΔQ/Δt = -k.A. Δt/Δx şeklindedir. Bu bağıntıdaki ΔT/Δx ifadesine, birim uzaklığa göre sıcaklık değişimi denir.
Isı aktarım hızı, kesit alanı ve sıcaklıkla doğru, kalınlıkla ters orantılıdır.
Isının Taşıma (Konveksiyon) Yolu İle Yayılması
Sıvılar ve gazlar akışkandır. Sıvı ya da gaz haldeki maddeler ısıtıldığında genleşir, hacmi artar. Hacmi artan taneciklerin özkütlesi azalır. Özkütlesi azalan tanecikler yukarıya doğru yükselmeye başlar. Böylece, tanecik aldığı ısı enerjisini bir yerden başka bir yere taşımış olur. Isınan tanecik yukarıya yükseldiğinde, soğuk tanecikler dibe çöker. Onlar da ısınınca yukarıya çıkar. Böylece ısı, taneciklerin hareketi ile tüm ortama yayılmış olur.
Sobalardan ve kalorifer peteklerinden yayılan ısı enerjisi, hava moleküllerinin ısıyı taşıma yolu ile yaymasıyla evlerimizi ısıtır.
Isının Işıma (Radyasyon) Yolu İle Yayılması
11. sınıfta bütün maddelerin her sıcaklıkta (0 °K üzerinde) ışıma yaptığını öğrenmekteyiz. Bir maddenin sıcaklığı arttıkça daha düşük dalga boylu (daha büyük enerjili) ışıma yapar. Bir maddenin sıcaklığı ile yaptığı ışımanın dalga boyu arasındaki ilişki Wien yer değiştirme yasası ile bulunur.
Bu yasaya göre, sıcaklığı T olan bir maddenin en çok ışıma yaptığı dalga boyu λ ise, λmax.T = 2,898.10-3 m.°K eşitliği geçerlidir.
İyi ışıma yapan maddeler aynı zamanda enerjiyi iyi soğurur. Dolayısı ile ışığı iyi soğuran maddeler iyi yansıtmaz. Genellikle koyu renkli cisimler, açık renkli cisimlere göre daha kötü yansıtıcıdır. Bunun için yazları açık renkli elbiseler, kışları ise koyu renkli elbiseler tercih edilir.
Soba ile duvar arasına yerleştirilen parlak metal levhalar, elektrikli ısıtıcılarda akkor telin ardına yerleştirilen parlak yüzey, termosların iç kısımlarında kullanılan parlak yüzeyler ısının ışıma yolu ile kaybolmasına engel olmak için kullanılır. Isı, bu parlak yüzeylere çarptığında yansımaya uğrar.
Bir madde aynı anda ışıma ve soğurma yapıyorsa bu maddenin sıcaklık değişimi bu dengeye bağlıdır. Yani yaptığı ışıma, soğurduğu ışımadan büyük ise maddenin sıcaklığı azalır. Bu iki değer birbirine eşit ise sıcaklık değişimi gözlenmez.
Üzerine gelen ışığı geçiren cisimlere saydam cisim denildiğini biliyoruz. Işığı soğuran ya da geçirmeyen maddelere opak madde denir. Fakat bazı durumlarda saydam olarak bildiğimiz maddeler opak, opak olarak bildiğimiz maddeler saydam özelliği gösterebilir. Örneğin cam yüksek enerjili ışık karşısında saydam bir madde gibi davranırken, çok düşük enerjili ışık karşısında (radyo dalgası) opak bir madde gibi davranır. Ya da duvar güneş ışığını geçirmediği halde X ışınlarını geçirerek saydam bir madde gibi davranabilir.
Isının iletim ve konveksiyon yolu ile yayılabilmesi için maddesel bir ortama ihtiyaç vardır. Fakat ışıma yolu ile ısının iletilmesi için maddesel bir ortama gerek yoktur. Güneşten ve diğer yıldızlardan dünyamıza gelen ışık bu şekilde yayılmaktadır.
0 °K sıcaklığın üzerindeki bütün cisimlerin molekülleri titreşim hareketi yapar. Yüklerin ivmeli hareketi ile elektromanyetik dalgalar oluşur. Bir cismin yaydığı ışığın (elektromanyetik dalganın) enerjisi sıcaklığı ile doğru orantılıdır. Denge sıcaklığına ulaşan bir cismin saldığı ışık miktarı, soğurduğu ışık miktarına eşittir.
Hal Değişimi
Katı, sıvı, gaz hallerinde bulunabilen maddeler bir halden diğer bir hale geçiş yapabilir. Bu geçiş için ya maddeye ısı verilmeli ya da maddeden ısı alınmalıdır.
Katı haldeki maddelere ısı verilince, moleküller hızlanır, molekülleri bir arada tutan bağlar zayıfladığı için madde erimeye başlar. Eriyip sıvı hale geçen maddeye ısı verildiğinde moleküller arasındaki bağlar koptuğu için madde kaynamaya başlar. Kaynayan sıvı, gaz haline geçer. Bu olayların terli de gerçekleşir. Gaz halindeki bir madde ısı kaybettiğinde yoğunlaşarak sıvı hale geçer. Sıvı haldeki bir madde, ısı kaybettiğinde donarak katı hale geçer. Maddeler hal değiştirirken sıcaklığında bir değişme olmaz. Hal değişimi ile ilgili bazı tanımlar aşağıdaki gibidir.
Hal Değiştirme Isısı
1 gram maddenin hal değiştirmesi için gerekli olan ısı miktarına, hal değiştirme ısısı denir. Ayırt edici bir özelliktir. L harfi ile gösterilir. Madde eriyorsa erime ısısı, donuyorsa donma ısısı denir. Aynı cins maddelerin erime ve donma ısıları eşittir. Bu nedenle 1 gram buzun erimesi için gerekli olan ısı değeri ile 1 gram suyun donarken ortama verdiği ısı değeri aynıdır. Bu değer ise 80 kaloridir.
Benzer biçimde 1 gram suyun kaynaması için gerekli olan ısı değeri ile 1 gram su buharının yoğunlaşırken ortama verdiği ısı değeri aynıdır. Bu değer ise 540 kaloridir. 1 gram maddenin hal değiştirmesi için gerekli olan ısı miktarı L ise, m gram maddenin hal değiştirmesi için gerekli olan ısı miktarı
Q = m.L formülü ile ifade edilir.
Erime ve Donma Sıcaklığı
Sabit basınç altında bütün katı maddelerin, katı halden sıvı hale geçtiği sabit bir sıcaklık vardır. Bu sıcaklığa erime sıcaklığı denir. Deniz seviyesinde buzun erime sıcaklığı 0 °C’dir.
Sabit basınç altında bütün sıvı maddelerin, sıvı halden katı hale geçtiği sabit bir sıcaklık vardır. Bu sıcaklığa donma sıcaklığı denir. Deniz seviyesinde suyun donma sıcaklığı 0 °C’dir.
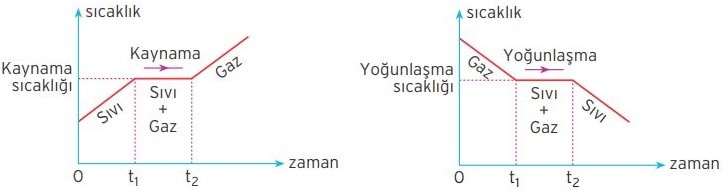
Kaynama ve Yoğunlaşma Sıcaklığı
Sabit basınç altında bütün sıvı maddelerin, sıvı halden gaz hale geçtiği sabit bir sıcaklık vardır. Bu sıcaklığa kaynama sıcaklığı denir. Deniz seviyesinde suyun kaynama sıcaklığı 100 °C’dir.
Sabit basınç altında bütün gaz maddelerin, gaz halden, sıvı hale geçtiği sabit bir sıcaklık vardır. Bu sıcaklığa yoğunlaşma sıcaklığı denir. Deniz seviyesinde su buharının yoğunlaşma sıcaklığı 100 °C’dir.
Süblimleşme
Bir katının sıvı hale geçmeden doğrudan gaz haline geçmesine süblimleşme denir. Bu maddelere örnek; naftalin ve iyot verilebilir.


