Asitler
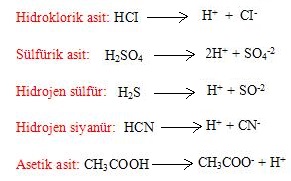
Sulu çözeltilerine H+ iyonu verebilen bileşiklere asit denir.
Örnek:
Asitlerin Özellikleri
1. Suda çözüldüklerinde iyonlarına ayrışabildiği için sulu çözeltileri elektrik akımını iletir.
2. Tadı ekşidir.
3. (Cildi ve eşyaları) Tahriş edicidir, yakıcıdır.
4. Mavi turnusol kağıdını kırmızıya çevirirler.
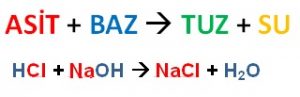
5. Bazlarla nötrleşme tepkimesi vererek tuz ve su oluştururlar.
Nötrleşme Tepkimesi: Asit – baz tepkimelerine nötrleşme tepkimesi denir. Bu tepkime sonucunda su ve tuz oluşur.
6. Aktif metaller (Al, Li, Be, Na, Mg, K, Ca, Fe gibi) ile tepkimeye girdiklerinde tuz ve H2 gazı ortaya çıkar. Bu nedenle asitle metal kaplarda saklanamaz.
Bazlar
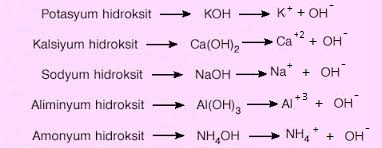
Sulu çözeltilerine OH- iyonu verebilen bileşiklere baz denir.
Örnek:
Bazların Özellikleri
1. Suda çözüldüklerinde iyonlarına ayrışabildiği için sulu çözeltileri elektrik akımını iletir.
2. Tadı acıdır.
3. Ele kayganlık hissi verir.
4. Kırmızı turnusol kağıdı maviye çevirir.
5. Asitlerle nötrleşme teplimesi vererek tuz ve su oluştururlar.
Nötrleşme Tepkimesi: Asit – baz tepkimelerine nötrleşme tepkimesi denir. Bu tepkime sonucunda su ve tuz oluşur.
6. Kuvvetli bazlar (NaOH ve KOH gibi), Al, Zn, Sn gibi anfoter metallere etki ederek tuz ve H2 gazı oluştururlar.
Anfoter madde: Asitlere karşı baz, bazlara karşı asit özelliği gösteren maddelere denir.
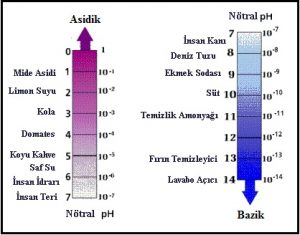
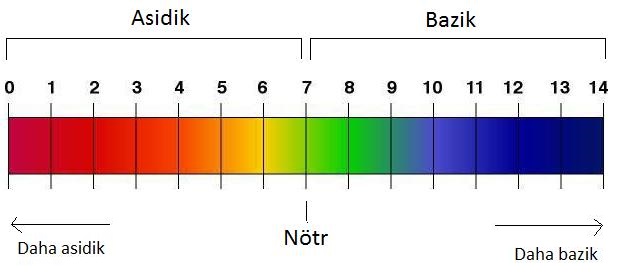
pH Cetveli
Bir çözeltinin ne kadar asidik veya ne kadar bazik olduğu pH kavramı ile ifade edilir.
– Çözelti, pH değeri 7 ise nötr,
pH değeri 0 – 7 ise asit,
pH değeri 7 – 14 ise bazik özelliktedir.
– Çözeltilerin pH’ı PH kontrol kağıtları ya da pH metre ile ölçülür.
– pH değeri 0 (sıfır)’a yaklaştıkça asidik özellikler artarken 14’e yaklaştıkça bazik özellikler artmaktadır.
İndikatör Maddeler
Asit ve bazların ayırımında indikatör adı verilen maddeler kullanılır. Turnusol kağıdı, fenolftalein, metil oranj ve lahana suyu bazı indikatörlerdir.