Birden fazla elementin belirli oranlarda kimyasal yollarla bir araya gelerek, kendi özelligini kaybedip oluşturdukları yeni saf maddeye bileşik denir. Bileşikteki atomların cins ve sayısını ifade etmeye bileşik formülü denir.
Kaba (Basit) Formül
- Bileşikteki atomların cinsini ve oranını belirten formüldür.
- Kaba formül ile bileşiğin molekül ağırlığı hesaplanamaz.
Gerçek (molekül) formül
- Bileşikteki atomların cinsini, oranını ve sayısını belirten formüldür.
- Bileşiğin molekül ağırlığı hesaplanabilir.
- İyonik bağlı bileşiklerin kaba formülleri ile gerçek formülleri aynıdır. Kovalent bağlı bileşiklerde ise bir tane kaba formüle ait çok sayıda gerçek formül olabilir.
| Fe2O3 | « | Fe2O3 |
| NO2 | « | NO2, N2O4 |
| CH2 | « | CH2, C2H4, C5H10 … gibi |
BAZI ELEMENT VE KÖKLERİN İSİMLERİ ve DEĞERLİKLERİ

Formül Yazma ve İsimlendirme
1. Metal + Ametal Bileşikleri
İsim: Metalin adı + Ametalin adı + ÜR. eki
- Ametal Oksijen ise, oksit şeklinde isimlendirme yapılır.
Not: Farklı degerlik alabilen metal bileşikleri isimlendirilirken metalin, o bileşikte aldığı değerlik belirtilmelidir.
| Ba+2 Br– | ® | BaBr2 ® Baryum bromür |
| Al+3 S-2 | ® | Al2S3 ® Aliminyum sülfür |
| Na+1 O-2 | ® | Na2O ® Sodyum oksit |
| Fe+2 Cl– | ® | FeCl2 ® Demir (II) klorür |
| Fe+3 Cl- | ® | FeCl3 ® Demir (III) klorür |
| Fe+2 O- | ® | FeO ® Demir (II) Oksit |
| Kurşun(II)Oksit | ® | Pb+2O-2 ® PbO |
| Mangan(IV)oksit | ® | Mn+4O-2 ® MnO2 |
2. Metal + Kök Bileşikleri
İsim: Metalin adı + Kök adı
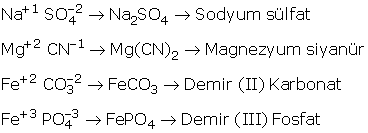
3. Ametal + Ametal Bileşikleri
Bileşik isimlendirilirken bileşikteki atomların sayısı, 1(mono), 2(di), 3(tri), 4(tetra), 5(penta), 6(hegza) gibi latince harflerle ifade edilir. Formülde önce yazılan atom bir tane ise yalnızca ad ı söylenir.
ılk yazılan atomun sayısı birden farklı ise onun da latince olarak kaç tane olduğu belirtilir. Sonraki atomun sayısı kaç olursa olsun sayısı belirtilmelidir.
| CO | ® | Karbon monoksit |
| CO2 | ® | Karbon dioksit |
| N2O5 | ® | Diazot pentaoksit |
| SF6 | ® | Kükürt hekza florür |
DEĞERLİK BULMA
- A grubu metalleri bileşiklerinde daima aynı değerliği alırlar.
- B grubu metalleri (Geçiş metalleri) bileşiklerinde farklı (+) değerlik alabilirler.
- Ametallerin (-) değerlikleri genellikle bir tanedir. Fakat farklı (+) değerlik alabilirler.
- Hidrojenin değerligi ametallerle yaptığı bileşiklerde (+1), metallerle yaptığı bileşiklerde (-1) dir.
- Oksijenin degerligi peroksitler hariç (-2) dir.
- Element halindeki atomların değerliği ve bileşiğin toplam yükü sıfırdır.
Not: Değerliği bilinen elementler yardımıyla bilinmeyenler bulunabilir. Bileşik nötr ise yükler toplamı sıfır olacaktır.
Örnek
Aşağıdaki elementlerin değerlik bulunmalarını inceleyiniz.
?
- K2CrO4 Þ K = +1,O = – 2 olduğundan2(+1) + Cr + 4 . (– 2) = 0Cr = + 6 bulunur.
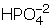 iyonundaki P nin değerliğini bulalım.+ 1 + P + (–8) = –2P = + 5 olarak bulunur.
iyonundaki P nin değerliğini bulalım.+ 1 + P + (–8) = –2P = + 5 olarak bulunur.
BİLEŞİKLERİN SINIFLANDIRILMASI ASİTLER
ASİTLER
- Suya H+1 iyonu verebilen bileşiklere asit denir.
- (Cu, Hg, Ag, Pt, Au) metalleri hariç diğer tüm metallerle H2 gazı açığa çıkar.
- Sulu çözeltileri elektrik akımını iletir.
- Turnusol kağıdını kırmızıya boyarlar.
- Bazlarla reaksiyona girerek tuz oluştururlar.
- Tadları ekşidir.
- Asidin değerliği: Suya verdiği H+ iyonu sayısıdır.
HBr® H+ + Br– (1) değerlikli
H2CO3 ® 2H+ + CO3–2 (2) değerlikli
CH3COOH® CH3COO– + H+ (1) değerlikli - Asitin kuvvetliliği: Suda %100 iyonlaşabilen asitlere kuvvetli asit, %100 iyonlaşamayanlara zayıf asit denir.Elektrik akımını iyi ileten asitlere kuvvetli asit, iyi iletmeyenlere zayıf asit denir.Periyotlar cetvelinde ise soldan sağa doğru ve yukarıdan aşağıya doğru asitlik kuvveti artar.
BAZ
- Suya OH- iyonu verebilen bileşiklere baz denir. Metal hidroksitler bazdır.
NH3 ®Amonyak bazı - Kuvvetli bazlar anfoter (Al, Zn) metallerle H2 gazı açığa çıkarırlar.
- Sulu çözeltisi elektrik akımını iletir.
- Turnusol kağıdını maviye boyarlar.
- Asitlerle reaksiyona girerek tuz oluştururlar.
- Tadları acıdır. Ele kayganlık hissi verirler.
- Bazın değerliği: Suya verdiği OH- iyonu sayısıdır.
KOH ® K+ + OH– (1) değerlikli
Ca(OH)2 ® Ca+2 + 2OH– (2) değerlikli - Bazın kuvvetliliği: suda %100 iyonlaşabilen bazlara kuvvetli, suda %100 iyonlaşamayanlara zayıf baz denir.
Elektrik akımını iyi ileten bazlara kuvvetli, iletmeyenlere zayıf baz denir.
Periyotlar cetvelinde sağdan sola ve yukarıdan aşağıya bazlık kuvveti artar.
TUZLAR
Baz katyonu ile, asit anyonundan oluşan bileşiklere tuz adı verilir.
HCl + KOH ® KCl + H2O
Ca(OH)2 + HCN ® Ca(CN)2 + H2O
CH3COOH + Mg (OH)2 ® Mg(CH3COO)2 + H2O
- Kuvvetli asit + Kuvvetli baz ® Nötr tuz
- Kuvvetli asit + Zayıf baz ® Asidik tuz
- Zayıf asit + Kuvvetli baz ® Bazik tuz
OKSİTLER
Flor haricindeki elementlerin O2 ile yaptığı bileşiklere oksit adı verilir.
1. Asidik oksit
Ametallerin oksijence zengin olan bileşiklerine denir.
CO2, SO2, SO3, P2O5 …
a. Su ile asitleri oluştururlar.
CO2 + H2O ® H2CO3
b. Bazlarla tuz oluştururlar.
CO2 + 2KOH ® K2CO3 + H2O
2. Bazik oksit
Genellikle metal oksitler bazik oksittir.
Na2O, CaO, Ag2O, CuO …
a. Su ile bazları oluştururlar.
Na2O + H2O ® 2NaOH
b. Asitlerle tuz oluştururlar.
K2O + 2HNO3 ® 2KNO3 + H2O
3. Nötr oksit
Ametallerin oksijence eşit veya fakir olan oksitlerine nötr oksit denir.
CO, NO, N2O …
a. Asitlerle, bazlarla ve su ile etkileşmezler.
b. Oksijen ile tekrar yakılabilirler.
CO + 1/2 O2 ® CO2
4. Anfoter oksit
Hem asit ile hem de bazla ayrı ayrı reaksiyona girebilen maddelere anfoter maddeler denir.
Asitlere karşı baz, bazlara karşı asit özelliği gösteren maddelere denir.
Al2O3, ZnO, Al(OH)3, Zn(OH)2
5. Peroksit
iki tane Oksijenin toplam değerliği (O2)–2 ise, bu bileşiklere peroksit denir.
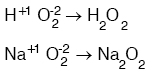
a. Bu oksitler ısıtılınca kolayca O2 gazı verirler.
ısı
CaO2 ¾¾® CaO + 1/2O2
6. Bileşik Oksit
Farklı değerlik alabilen metal oksitlerin birleşmesi ile oluşan bileşiklere bileşik oksit denir. Bileşiğin yapısında metal her iki değerliğini de bulundurur.
FeO + Fe2O3 ® Fe3O4
PbO + PbO2 ® Pb2O3
2PbO + PbO2 ® Pb3O4